|
نظريه اتمي دالتون Douton,s Atomic Theory
بر اساس فرضيه Democritus و ديگر دانشمندان يوناني، تا سال 1803 چنين عقيده اي رايج بود كه هر ماده پس از تقسيم شدن پي در پي، بالاخره به اتم مي رسد كه غير قابل تقسيم شدن است .در اين سال دالتون نظريه كاملتري را به شرح زير ارائه نمود : 1- هر عنصر از ذرات بسيار ريز به نام اتم درست شده كه تقسيم ناپذير است. 2- جرم و تعداد اتم هاي موجود در يك عنصر با هم يكسان هستند ولي اتم هاي يك عنصربا عنصر ديگر تفاوت دارد. 3- در واكنشهاي شيميايي هيچ اتمي به اتم ديگر تبديل نمي گردد، هيچ اتمي خود به خود ساخته نمي شود، هيچ اتمي از بين نمي رود فقط اتم ها از هم جدا مي شوند و يا به هم مي پيوندند. 4- يك ماده مركب، از پيوستن اتمهاي دو يا چند عنصربوجود مي آيد و در چنين ماده اي تعدادونوع اتمها همواره ثابت است. موارد ماندگار از نظرية دالتون قانون بقاي جرم، قانون نسبتهاي معين، قانون نسبتهاي چند برابر. موارد رد نظريه دالتون 1- اتم قابل تجربه است [انتشارسه نوع اشعه ازموادراديواكتيونشان مي دهدكه اتم را ميتوان به ذرات الكترون وپروتون ونوترون تجزيه كرد]. 2- جرم اتمهاي يك عنصر مي تواند متفاوت باشد [ايزوتوپ هاي برخي از عناصر، جرم اتمي متفاوت دارند]. موارد نقص نظريه دالتون در نظريه دالتون از ظرفيت، خاصيت الكتريكي مواد وتغيير رفتار عناصر در گروه ها ودورهاي جدول تناوبي بحثي نشده است . قانون بقاي جرم (پايستاري) لاووازيه Law of conservation of matter در فرايندهاي شيميايي نه اتمي ايجاد مي شود ونه ازبين مي رود، فقط اتم ها جابجا مي شوند در نتيجه جرم كل اتم هايي كه وارد واكنش مي گردند با جرم كل محصولات واكنش برابر خواهد بود . اين قانون با اصل سوم دالتون همخواني دارد. قانون نسبت هاي معين پروست Law of constant composition عناصر سازندة يك ماده مركب خالص معين از لحاظ تعداد و جرم اتم هاي شركت كننده در آن، داراي نسبتي هستند كه همواره ثابت است. مثلاً چنانچه آب را به هر مقدار و به هر روش تجزيه كنيم در همه حال وزن اكسيژن آن 81/88% و هيدروژن آن 19/11% خواهد بود. اين قانون با اصل چهارم دالتون همخواني دارد. قانون نسبت هاي چند برابر Law of multiple proportion دالتون از نظريات مطروحة خود قانون "نسبت هاي چندبرابر" را نيز استنتاج نمود به اين ترتيب كه: اگر جرم ثابتي از عنصر A با جرم هاي متفاوتي از B تركيب شود. نسبت جرم هاي متعدد Bبا يكديگر اعدادي صحيح، ساده و كوچك است. مثلاً دو گرم هيدروژن با 16 گرم اكسيژن توليد آب و با 32 گرم اكسيژن پرهيدرول [اكسيژن پراكسايد] را مي نمايد كه نسبت 32 به 16 يعني 2، عددي است صحيح و ساده و يا در N2O5 , N2O4 , N2O3 , NO, N2O جرمهاي اكسيژن به ترتيب 64، 48، 32، 16و 80 است كه نسبتهاي آنها به يكديگر 2 = ، =3 و.......... ميباشد. اتم قابل تجزيه است اثبات وجود الكترون 1- ماهيت الكتريكي ماده تا اواخر قرن 19 ميلادي، آزمايش هاي زيادي براي نشان دادن ماهيت الكتريكي ماده صورت مي گرفت مثلاً Davy باتجزية مواد مركب Na Cl].......] توسط الكتريسيته به اين نتيجه رسيد كه هر مولكول از تعدادي اتم تشكيل شده كه در اثر جاذبه الكترواستاتيكي موجود بين بارهاي الكتريكي غير همنام به هم پيوسته اند ضمناً بارها وقتي پيدا مي شوند كه دو جسم مستعد به هم نزديك گردند. Berzelius اعتقاد داشت كه بارهاي الكتريكي از پيش در اتم ها وجود دارند. Farady رابطه بين مقدار الكترسيته مصرفي و مقدار ماده مركب تجزيه شده را بررسي كرد.بر مبناي كار فاراده، Stoney پيشنهاد كرد كه واحدهاي بار دار الكتريكي با اتم ها ارتباط دارند و آنها را الكترون ناميد. بعدها پرتو كاتدي كشف شد و آزمايش ها نشان داد كه اين پرتو از ذراتي با بار منفي كه حركت سريع دارند تشكيل شده است. اين ذرات همان طوري كه اٍستوني پيشنهاد كرده بود الكترون ناميده شد. 2-آزمايش هاي پرتو كاتدي كروكس و تامسون با استفاده از الكتريسيته بر روي اتم (الكترون) مطالعات بسيار ارزنده داشتند. 1-2- آزمايش Crookes كروكس در دو انتهاي يك لوله شيشه اي مسدود، دو صفحه فلزي كه به آن الكترود مي گويند قرار داد سپس هر صفحه را به يك قطب از يك منبع با ولتاژ بالا وصل نمود. چون هواي داخل لوله شيشه اي با فشار معمولي پُر شده بود به علت تراكم مولكول هاي هوا، قاعدتاً هيچگونه جريان الكتريكي نمي توانست واقع شود. لكن به محض اينكه پمپ تخليه فشار داخل لوله به 10mmHg كاهش يافت، با كم شدن تراكم مولكول هاي هوا و باز شدن فضاي داخل لوله، جريان الكتريسيته از طرف صفحه كاتد (بارمنفي) به طرف صفحه آند (بارمثبت) بر قرار گرديد و فضاي لوله روشن شد. به اين پرتو كه از كاتد سرچشمه مي گيرد پرتو كاتدي مي گويند. كروكس با نزديك كردن يك آهن ربا به لوله شيشه اي و منحرف شدن اشعه از مسير مستقيم خود نتيجه گرفت كه پرتو كاتدي از ذراتي ساخته شده كه داراي بار الكتريكي هستند. 2-2- آزمايش تامسون Thamson تامسون دوصفحه اي كه هريك به قطبي ازيك منبع باولتاژ پائين وصل شده بود به لوله شيشه اي آزمايش كروكس نزديك كرد و مشاهده نمود كه مسير مستقيم پرتو به طرف صفحه با بار مثبت منحرف مي شود و نتيجه گرفت كه بارالكتريكي ذرات تشكيل دهنده پرتو كاتدي منفي است و همانطوري كه Stoney پيشنهاد كرده بود آن را الكترون ناميد. اگر چه تامسون نمي توانست جرم و اندازه بار الكترون را اندازه بگيرد لكن از طريق ميزان انحراف مسير پرتو كاتدي در يك ميدان مغناطيسي با قدرت مشخص توانست نسبت بار الكتريكي (e) را به جرم الكترون (m) به دست آورد. اين نسبت كه به آنelm مي گويند برابر است: [علامت منفي نشان دهندة منفي بودن بار الكترون است]. دانستن اين نسبت و قادر نبودن به اندازه گيري جرم الكترون مشابه اين مطلب است كه اگر نتوانيم جرم يك سيب و يا هسته آن را اندازه بگيريم لكن مي توانيم بگوئيم كه جرم سيب مثلا ًهزار برابر هسته آن است. تامسون همچنين نشان داد كه پرتو كاتدي به جنس فلز كاتد بستگي ندارد. 3-2- بار الكترون – آزمايش ميليكان (Millikan) ميليكان توانست مقدار مطلق بار الكتريكي الكترون را با انجام آزمايش زير به دست آورد: جعبه اي فراهم كرد كه در داخل آن دو جوشن يك خازن قرار داشت. در صفحه بالايي كه داراي بار مثبت بود يك منفذ با دريچه تعبيه نمود. ابتدا به وسيله افشانه روغني را در محفظة بالاي جعبه پاشيد، بعد با تاباندن اشعه X به مولكول هاي هوا، الكترون هاي آنها را جدا كرد. وقتي يك قطره از روغن از منفذ فوق عبور نمود، دريچه آن را بست. ذره روغن تحت تأثير نيروي جاذبه به طرف پائين سقوط كرد ولي چون با جذب الكترون بار منفي به خود گرفت در نتيجه به طرف جوشن مثبت رو به بالا برگشت. ميزان بالا رفتن قطره را توسط عدسي چشمي مدرج مشاهده و اندازه گيري نمود. ميليكان پس از حدود هزار بار آزمايش نتيجه گرفت كه با وجود آنكه بار قطرات مختلف با هم فرق داشت لكن بار الكتريكي هر قطره همواره مضرب صحيحي از عدد كوچك -1.6 . 10-19 كولمب بود. اين مقدار به عنوان بارالكتريكي الكترون انتخاب شد. با توجه به اينكه تامسون مقدار را محاسبه كرده بود ميليكان پس از محاسبه (e) جرم الكترون را نيز به دست آورد كه برابر بود با9.1 . 10-28 گرم. نتايج آزمايش پرتو كاتدي 1- پرتو كاتدي يك موج نيست بلكه عبارتست از ذراتي كه داراي جرم و بار منفي است و به آن الكترون مي گويند. 2- مسير پرتو كاتدي مستقيم است. 3- ذرات منتشره از كاتد، به نوع فلز كاتد و يا گازي كه بدواً در لوله پر شده باشد بستگي ندارد. 4- چون بار پرتو منفي است، در ميدان الكتريكي به طرف قطب مثبت ميدان منحرف مي شود. 5- درجه اين انحراف با بار ذره (e) نسبت مستقيم و با جرم ذره ( m ) نسبت معكوس دارد. پس نسبت بار به جرم ( ) معين كننده ميزان انحراف الكترون ها از مسير مستقيم در ميدان الكتريكي است. به عنوان مثال بين 39K+ , 23Na+ درجه انحراف Na بيشتر است [زيرا جرم كمتري دارد] و بين 40Ca+ , 40Ca++ درجه انحراف40Ca++ بيشتر مي باشد [زيرا بار بيشتري دارد]. به طوركلي هر چقدر نسبت ( ) بيشتر باشد انحراف بيشتر خواهد بود مثلاً بين : [ = = ] ++ و [ = = ] +++ و [ = = ]++ درجه انحراف عبارتست از He2+ > Al3+> Ca2+ 6- الكترون ها در ميدان مغناطيسي نيز منحرف مي شوند ولي در اينجا انحراف عمود بر ميدان است. اثبات وجود پروتون گلداشتاين (Goldstein) صفحه كاتدي لولة شيشه اي آزمايش كروكس را به صورت سوراخ دار درست كرد و در اين شكل جديد آزمايش كروكس را تكرار نمود. در اين حالت او نه تنها جريان الكترون ها را از طرف كاتد به آند ديد بلكه پرتوهاي مثبت را نيز در ناحيه پشت كاتد مشاهده كرد. امروزه مي دانيم كه اگر از يك اتم خنثي [تعداد بار مثبت و منفي برابر]، چند الكترون جدا شود، باقيمانده اتم به همان اندازه بار مثبت پيدا مي كند. به اين ترتيب وقتي در آزمايش وي پرتو كاتدي در مسير حركتش بطرف آند تعدادي الكترون را از اتم هاي گاز موجود در لوله جدا نمود. معادل اين تعداد الكترون، ذرات با بار مثبت (پروتون) به طرف كاتد جريان پيدا كرد.چون بار الكتريكي پروتون مثبت است به اين جريان، پرتو مثبت مي گويند. انواع گازها، انواع متفاوتي از پروتون را ايجاد مي كنند. جرم پروتون حاصل از گاز هيدروژن از هر يون مثبت ديگري كمتر است و جرم پروتون 1836 برابر جرم الكترون مي باشد. |
اطلاعات کاربری
آرشیو
آمار سایت


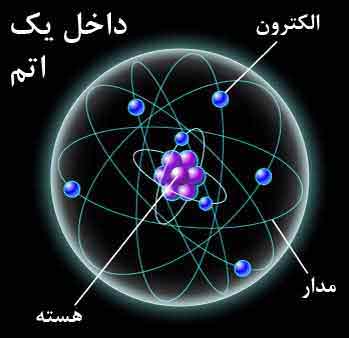
 ساختمان اتم
ساختمان اتم